Објашњавамо шта је атом и како се састоји сваки од његових делова. Такође, његова историја, студије о томе и шта је молекул.

Шта је атом?
Најмања јединица која чини материја.
Реч атом потиче из старогрчког (атом, „Без поделе“) и сковали су га први филозофи да теоретишу о саставу ствари, односно о елементарним честицама универзум. Од тада, са појавом атомски модели, начин њиховог замишљања је веома варирао, пошто је атомски модел наследио претходни кроз векове, све док нисмо дошли до оног који користимо данас.
Атоми имају својства хемијски елемент који сачињавају и, заузврат, елементи су организовани и класификовани према својим атомски бројеви, електронска конфигурација и хемијска својства у Периодни систем од елемената.
Исти хемијски елемент може бити састављен од различитих атома исте класе, односно са истим атомским бројем (број протона које сваки атом има у елементу), иако су њихове атомске масе различите.
На пример, постоје различити атоми истог елемента који се разликују по броју неутрони, а називају се изотопи, репрезентативан случај су изотопи елемента угљеника (12Ц, 13Ц, 14Ц). Дакле, сваки атом припада истом хемијском елементу или не, у зависности од његовог броја протона, па атоми са истим бројем протона припадају истом хемијском елементу.
Како је састављен атом?
Атоми се састоје од језгра и једног или више електрона (који имају негативно наелектрисање) око њега. Језгро се састоји од честица које се називају протони и неутрони. Протони су позитивно наелектрисани, а неутрони неутрални. Скуп протона и неутрона назива се нуклеони.
Протони и електрони се међусобно привлаче електромагнетном силом (интеракција наелектрисаних честица са електричним и магнетним пољима), док се протони и неутрони међусобно привлаче нуклеарном силом (сила коју доживљавају само честице које чине атомско језгро).
Како се атоми комбинују?
Атоми се могу комбиновати једни са другима да би се формирали хемијске везе, шта се дешава када деле своје електроне на овај или онај начин. Хемијске везе могу бити ковалентна, јонски И металик, који потиче ковалентна молекуларна једињења, јонске мреже или метална једињења (иако је важно разјаснити да ниједна хемијска веза није апсолутно ковалентна или јонска). На овај начин се атоми могу комбиновати и формирати молекуле једноставно попут Вода, као и да се формира макромолекуле сложен као беланчевина, ДНК И РНА.
Иако се атоми разликују једни од других захваљујући конфигурацији својих честица, такође је тачно да су сви атоми истог елемента потпуно идентични: атоми водоника у Нед Они су исти као они који чине наше тело, а атоми угљеника у телу пса су идентични онима који чине дијамант. Разлика је у начину на који се атоми комбинују да би сачинили различита хемијска једињења која чине органе и системе органа у жива бића, материјали настали у индустрија, и сву материју која чини универзум.
Делови атома
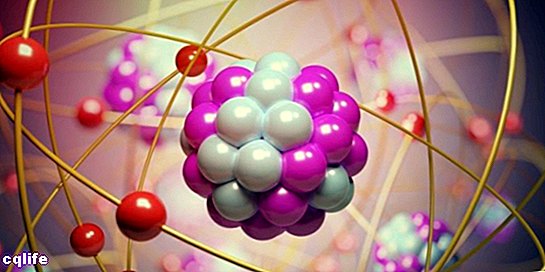
Атоми се састоје од два битна дела:
- Језгро. Око 99,94% масе атома је концентрисано у језгру, где се налазе протони и неутрони (који се заједно називају „нуклеони“), спојени јаким нуклеарним силама, што спречава да се протони које одбијају једни од других, имају исту електричну енергију. напунити.
- Атомске орбитале. Орбитала описује област простора која окружује атомско језгро у коме је вероватноћа проналажење електрона је веома висока. Ови региони имају различите облике који се добијају као резултат решавања стационарне Шредингерове једначине. Ервин Шредингер је био аустријски научник који је развио ову једначину 1925. да би израчунао еволуцију субатомске честице, као што су електрони. Тако електрони формирају неку врсту "облака" око језгра, који је представљен обликом атомских орбитала. С друге стране, свакој атомској орбитали одговара одређена енергетска вредност за електроне, па су они организовани према својим енергетским вредностима. На следећој слици су приказани облици првих атомских орбитала:

Историја атома

Први који је формулисао идеју о постојању атома био је грчки филозоф Демокрит (с.В-ВИ пре нове ере) из чисто измишљених спекулација (како се тада схватала наука).
Његовим студијама су се бавили каснији филозофи као што су Леукип и Епикур, али су то занемарени током средњевековни, засењено креационистичким објашњењем света, које је све приписивало Богу.
Морали смо да чекамо до 1773. године када је француски хемичар Антоан де Лавоазије поставио своју теорију о нестварању или уништавању материје (она само трансформише) или Закон одржања масе, што је омогућило Џону Далтону да формулише прву модерну атомску теорију 1804. године.
Узастопни научници физички анд тхе хемија били су инспирисани његовим радом да предложе боље и сложеније системе за разумевање основних честица материје. Након тога, предложени су нови атомски модели до оних који се данас највише користе.
Савремена прихваћена структура је она која потиче од експерименти Ратерфорда 1911. заједно са формулацијама Нилса Бора, Шредингера и Хајзенберга.
Молецуле
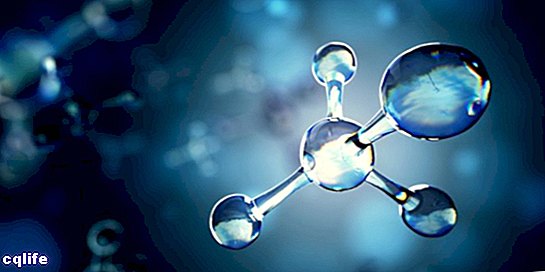
Молекул је познат као спој два или више атома путем хемијских веза да би се формирала сложенија и електрично неутрална структура. Хемијске везе могу бити ковалентне или јонске.
Молекули могу бити састављени од атома истог хемијског елемента, на пример, молекула кисеоника (О2), или од атома различитих хемијских елемената, на пример, молекула глукозе. Монатомски гасови, на пример хелијум (Хе), такође се сматрају молекулима.

